QUÍMICA [ESCS]
21 - Descargas elétricas em um tubo contendo um gás sob baixa pressão (gás rarefeito) provocam a ionização desse gás
pela retirada de elétron. Nesse caso, a força de atração do núcleo sobre os elétrons restantes:
(A) diminui, e, portanto, a primeira energia de ionização é sempre maior que a segunda;
(B) aumenta, e, portanto, a primeira energia de ionização é sempre menor que a segunda;
(C) diminui, e, portanto, a primeira energia de ionização é sempre menor que a segunda;
(D) aumenta, e, portanto, a primeira energia de ionização é sempre maior que a segunda;
(E) permanece constante se o segundo elétron a ser retirado estiver no mesmo nível de energia que o primeiro.
22 - A vaporização do etanol e sua posterior combustão acarretam rupturas de ligações denominadas, respectivamente:
(A) ligação hidrogênio e iônica;
(B) forças de London e covalente;
(C) covalente e iônica;
(D) ligação hidrogênio e covalente;
(E) forças de London e iônica.
23 - A massa de ácido salicílico necessária para
produzir um comprimido, considerando o rendimento do processo de 80%,
corresponde a:
(A) 102,4 mg;
(B) 110,4 mg;
(C) 138 mg;
(D) 144 mg;
(E) 172,5 mg.
24 - Um comprimido desse analgésico foi dissolvido
em água completando o volume de 100 mL. Considerando que somente o ácido
acetilsalicílico contribua para a acidez da solução e que este se encontra 1 %
ionizado, o pH dessa solução é:
(A) 2;
(B) 4;
(C) 5;
(D) 6;
(E) 8.
25 - Em um tubo fechado encontram-se as substâncias
gasosas NO2 e N2O4 em equilíbrio que pode ser
representado pela equação:
Ao colocarmos esse tubo em um banho de gelo,
observamos que a mistura gasosa fica praticamente incolor. Quando o mesmo tubo
é mergulhado em água fervente, a cor castanha é observada na mistura gasosa. A
respeito desse equilíbrio, avalie as afirmativas a seguir.
I- A coloração castanha é devida ao aumento da
concentração de NO2.
II- A mistura fica praticamente incolor devido ao
aumento da concentração do N2O4.
III- A reação direta é exotérmica.
IV- À temperatura ambiente, a adição de gás hélio
não altera a coloração da mistura.
Estão corretas as afirmativas:
(A) I e II;
(B) I, II e IV, apenas;
(C) III e IV, apenas;
(D) I, II e III, apenas;
(E) I, II, III e IV.
26 - O armazenamento do lixo radioativo é um dos
grandes obstáculos para o uso da energia nuclear. Atualmente, o lixo radioativo
é guardado em tanques subterrâneos. Segundo as normas internacionais, uma
quantidade de rejeito que apresenta atividade radioativa de 6 x 1012
desintegrações por minuto (dpm) só poderá ser desenterrada após 10000 anos,
quando a atividade estiver reduzida a 3 x 10–3
dpm, nível considerado inofensivo. O tempo de meia vida desse nuclídeo é aproximadamente
igual a: (use log 2 = 0,3)
(A) 100 anos;
(B) 200 anos;
(C) 400 anos;
(D) 800 anos;
(E) 1600 anos.
ATENÇÃO: O texto a seguir refere-se às questões 27
e 28.
Estudos mostraram que os nativos da Groenlândia,
apesar de terem uma dieta rica em gorduras e óleos, apresentam baixíssimos
índices de doenças cardiovasculares. Acredita-se que esse fato esteja
relacionado com a ingestão de óleos ricos em ácidos ômega-3 presentes em
animais marinhos, base da alimentação daquele povo. Os ácidos ômega-3 são
ácidos graxos e essa denominação refere-se à posição de uma dupla ligação,
numerando a cadeia a partir da extremidade oposta à do grupo funcional. Essa
numeração, entretanto, não é recomendada pela IUPAC. A estrutura a seguir
representa um exemplo de ácido ômega-3.
27 - Utilizando a regra de nomenclatura recomendada
pela IUPAC, essa dupla ligação deverá estar localizada no carbono:
(A) 2;
(B) 7;
(C) 11;
(D) 16;
(E) 19.
28 - O número de mols de H2 necessário
para saturar um mol do ácido ômega-3 é:
(A) 2;
(B) 3;
(C) 4;
(D) 5;
(E) 10.
29 - Na maioria das pilhas, são utilizados
eletrodos de metais diferentes, mas é possível construir pilhas com eletrodos
do mesmo metal desde que suas soluções eletrolíticas apresentem concentrações
diferentes. Um exemplo desse tipo de pilha está representado a seguir.
Com base nos potenciais padrão de redução, a ddp
dessa pilha corresponde a:
(A) + 0,62 V;
(B) + 0,08V;
(C) – 0,08V;
(D) + 0,35V;
(E) + 0,27V.
30 - Os sistemas óticos dos telefones celulares
modernos são produzidos a partir de elementos como silício, estanho, índio, gálio,
cobre, ouro, prata, ítrio e alumínio.Um grupo da tabela periódica reúne os
elementos citados que, no estado fundamental, apresentam em sua distribuição
eletrônica, o maior número de elétrons desemparelhados. Esse grupo é o:
(A) 4A;
(B) 3A;
(C) 1B;
(D) 8B;
(E) 3B.
31 - O 2-butanol é um álcool que apresenta isomeria
ótica e pode ser obtido, em condições apropriadas, a partir da reação do 2-cloro-butano
com uma base forte. A tabela abaixo apresenta algumas experiências realizadas
envolvendo diferentes concentrações iniciais dos reagentes:
O número de isômeros oticamente ativos do 2-butanol
e a ordem da reação de obtenção desse composto são, respectivamente:
(A) 2 e 2ª;
(B) 1 e 2ª;
(C) 2 e 1ª;
(D) 3 e 1ª;
(E) 1 e 3ª.
32 - Em 1980, os médicos Irineu Velasco e Maurício
da Rocha e Silva descobriram que a utilização de soluções hipertônicas contendo
7.500 mg de cloreto de sódio dissolvidos em 100 mL de solução aquosa
representava uma alternativa segura e eficiente para o tratamento de vítimas de
choque hemorrágico. Os tratamentos utilizados até então recomendavam, entre
outros procedimentos, a aplicação de grandes volumes de soro fisiológico
contendo 900 mg de cloreto de sódio em 100 mL de solução. Um determinado grupo
de pesquisadores decidiu realizar um estudo utilizando uma nova solução salina,
preparada a partir da combinação da solução hipertônica de Velasco e Silva com
o soro fisiológico convencional. A razão entre os volumes de soro fisiológico e
de solução hipertônica necessários para preparar uma solução com concentração
igual a 20 g/L de NaCl é igual a:
(A) 10;
(B) 7,5;
(C) 5;
(D) 2,5;
(E) 1.
33 - O taxol é uma molécula natural extraída da
casca de uma árvore, chamada Teixo do Pacífico (Taxus brevifolia), que
apresenta propriedades antitumorais, sendo atualmente utilizada no tratamento
de diversos tipos de câncer. A estrutura do taxol encontra-se representada a
seguir:
Uma das funções químicas presente nessa molécula é:
(A) ácido carboxílico;
(B) amina;
(C) fenol;
(D) aldeído;
(E) amida.
34 - O tipo de isomeria apresentada entre o ácido
acético e o composto B é:
(A) função;
(B) metameria;
(C) cadeia;
(D) posição;
(E) geométrica.
35 - A reação entre metanol e permanganato de
potássio produz MnO, além do composto B. Nessa reação, o KMnO4 atua
como:
(A) catalisador;
(B) redutor;
(C) oxidante;
(D) inibidor;
(E) acidulante.

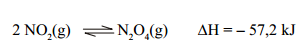








Comentários