QUÍMICA [UEFS]
Química
Questões de 21 a 40
Para responder a essas questões, identifique APENAS UMA ÚNICA alternativa correta e marque a letra correspondente na Folha de Respostas.
Questão 21
O gráfico mostra o processo de mudança dos estados físicos da água pura por meio de resfriamento, em função do tempo. A transformação física é iniciada com vapor de água e finalizada com a formação completa de gelo, a 1atm. Uma análise desse gráfico permite corretamente concluir:
A) As etapas I e II, no gráfico, correspondem, respectivamente, à ebulição e à fusão da água.
B) O processo de resfriamento da água é endotérmico.
C) A temperatura, durante a solidificação e a fusão da água, é constante porque os calores latentes de solidificação e de fusão da substância são iguais.
D) A 100°C, coexistem em equilíbrio físico água líquida e vapor.
E) O processo de resfriamento de vapor de água até 0°C envolve o aumento crescente de energia cinética das moléculas da substância.
Questão 22
Ao se determinar o ponto de ebulição, a 1atm, de uma amostra de uma substância líquida, colocada no interior de um tubo capilar, juntamente com um termômetro, em um banho de óleo mineral, verifica-se, após aquecimento controlado, que a temperatura de ebulição é maior do que a encontrada em tabelas de propriedades físicas.
A análise desse resultado sugere corretamente que
A) foi utilizada, durante a determinação, uma quantidade grande de substância química.
B) a amostra analisada é de uma substância composta pura.
C) a substância química analisada contém impurezas.
D) o coeficiente de dilatação térmica da amostra líquida é muito grande.
E) o calor latente de vaporização da substância química interferiu no resultado.
Questão 23
O cientista dinamarquês Niels Böhr
aprimorou, em 1913, o modelo atômico de E.Rutherford, usando a teoria de Max
Planck. Em 1900, Planck já havia admitido a hipótese de que a energia não seria
emitida de modo contínuo, mas em quantum, isto é pacote ou porção de energia.
Surgiram, assim, os postulados de Böhr e as explicações sobre os espectos
atômicos dos elementos químicos. Considerando-se os postulados de N. Böhr, as
explicações sobre os espectros atômicos e em relação à emissão de cor vermelha
no teste de chama pelo cloreto de estrôncio, SrCl2(s), é correto
afirmar:
A) A luz vermelha emitida pelo cloreto de
estrôncio está relacionada à cor branca do sal que reúne todas as cores dos
espectros atômicos.
B) Ao absorverem quanta de energia da
chama, os elétrons do íon Sr2+(g) retornam a um nível de
energia mais interno.
C) Os elétrons do cátion Sr2+(g),
ao retornarem de um nível de energia mais externo para outro mais interno,
emitem energia, sob forma de radiação eletromagnética.
D) A emissão de luz vermelha é propriedade
dos cátions de metais alcalinos terrosos.
E) O número de raias espectrais diminui
com o crescimento do número atômico dos elementos químicos porque, com o
aumento da temperatura da chama, cresce o número de transições eletrônicas.
Questão 24
Os elementos químicos do grupo 1, com exceção do hidrogênio, ilustram, de modo mais claro, do que em qualquer outro grupo, o efeito do tamanho dos átomos ou dos íons sobre as propriedades físicas e químicas relacionadas à estrutura atômica. Considerando-se as tendências das propriedades desse grupo de elementos químicos e ao relacioná-las com as de elementos químicos de outros grupos e períodos da Tabela
Periódica, é correto afirmar:
A) Os elementos químicos do grupo 1 não apresentam, regularmente, características metálicas, como condução da eletricidade, pequena dureza e alta reatividade, ao serem comparados aos demais elementos químicos.
B) O tamanho dos átomos desses elementos químicos diminui consideravelmente quando o elétron da camada mais externa é removido.
C) A energia de ionização dos átomos desses elementos aumenta com o aumento do número atômico no grupo.
D) O grupo 1 reúne de uma só vez os elementos químicos mais densos da Tabela Periódica.
E) O sódio é o único elemento químico que reage com a água e libera hidrogênio durante a reação.
Questão 25
Os íons Ga3+ e S2− apresentam raios iônicos com valores
muito diferentes. O íon sulfeto tem raio iônico
igual a 182pm e o cátion gálio, 62pm. A compreensão dessa diferença nos tamanhos
dos raios dos íons dos elementos químicos gálio e
enxofre permite corretamente concluir.
A) O raio covalente cresce da esquerda
para a direita nos períodos da Tabela Periódica.
B) O raio iônico aumenta de baixo para
cima nos grupos 13 e 16 da Tabela Periódica, de forma independente
do número atômico.
C) O crescimento da repulsão entre os
elétrons da camada de valência do átomo de enxofre, ao
receber dois elétrons, produz aumento de tamanho do íon, enquanto
o átomo de gálio diminui com a perda de camada de
valência e crescimento da carga nuclear relativa.
D) A carga nuclear aumenta com a
transferência de elétrons da camada de valência de um átomo mais
eletronegativo para outro mais eletropositivo.
E) À proporção que a carga positiva do
núcleo do átomo decresce em relação à carga da
eletrosfera, o raio iônico diminui.
Questão 26
No final do século XVIII, o cientista Antoine Laurent de Lavoisier realizou uma série de experiências em recipientes fechados, ao efetuar pesagens mais precisas do que a de seus colegas antecessores, conseguindo concluir e enunciar a Lei da Conservação da Massa. Quase na mesma época, Joseph Luis Proust, a partir de vários experimentos, chegou a conclusão de que as substâncias compostas são formadas de substâncias simples, sempre na mesma proporção em massa. A partir dos trabalhos desses cientistas, foram lançadas as bases experimentais da Química como Ciência, no século 18. Assim, em um experimento, inicialmente, foram aquecidos, em um tubo de vidro fechado, 10g de mercúrio na presença de ar. No final, verificou-se a formação de 5,4g de óxido vermelho de mercúrio ao lado de 5,0g de mercúrio. Considerados os resultados desse experimento e com base na Lei de A. L. Lavoisier e na conclusão a que chegou Louis Proust, é correto afirmar:
A) A fórmula do óxido vermelho de mercúrio, formado no experimento, é representada por HgO.
B) O coeficiente de proporcionalidade entre as massas de oxigênio e de mercúrio que se combinam é 0,04.
C) A composição centesimal do óxido vermelho de mercúrio é, aproximadamente, 96% de mercúrio e 4% de oxigênio.
D) A massa de mercúrio que reagiu durante o experimento é 4,6g.
E) A soma da massa de mercúrio com a de óxido de mercúrio, igual a 10,4g, evidencia que resultados não estão de acordo com a Lei da Conservação da Massa de Lavoisier.
Questão 27
O caminho para o futuro energético do
Japão pode passar pela cidade de Sapporo, no norte do país, onde
pesquisadores estudam sedimentos que contêm hidrato de
metano, CH4(H2O)n,
formações de gelo com gás metano no seu interior, “gelo inflamável”, conforme mostra a
figura. Os sedimentos são encontrados em grandes quantidades tanto
sob o mar quanto no permafrost. O metano, p.e = −162,6, é
produzido a partir da atuação de micro-organismos, sob condições
especificas de calor, de pressão e de temperatura, sobre
a matéria orgânica e migra para cima nos sedimentos. O
hidrato de metano sólido se forma nos espaços microscópicos entre
grãos de sedimentos arenosos e argilosos, em
determinadas condições de temperatura e de pressão.
Para a produção de energia, os grãos retirados dos sedimentos
arenosos são os preferidos pelos pesquisadores. As buscas por fonte de energia que venham
suprir as necessidades cada vez maiores da
humanidade, se debruçam agora, sobre o panorama dos depósitos dos
hidratos de metano espalhados sob os mares e o
permafrost do Planeta. Considerando-se as informações do texto, o
combustível aprisionado na estrutura do gelo e suas
propriedades, é correto concluir:
A) As interações intermoleculares entre as
moléculas de água com o metano no hidrato de metano são
de natureza dipolo permanente-dipolo induzido.
B) O metano no interior da estrutura do
gelo a − 40°C e sob pressão, se apresenta no estado líquido.
C) O metano retirado dos sedimentos
arenosos, sob determinadas condições de temperatura e de
pressão possui menor poder calorífico por
quilograma do que o encontrado nos sedimentos argilosos.
D) O metano retirado dos sentimentos é
fonte de energia renovável porque é biodegradável e não
causa efeito estufa, ao se espalhar na atmosfera do
Planeta.
E) A chama do metano é fria porque todo o
calor produzido durante a combustão é absorvido para
fundir a água.
Questão 28
O cloreto de hidrogênio, HCl(g),
é um gás incolor, não inflamável, muito tóxico e corrosivo. É solúvel em água,
cerca de 450L de gás por litro de água, em condições ambientes, 25°C e 1atm. A
solução aquosa comercial é incolor e, quando concentrada, contém 38% de HCl em
massa e possui densidade de 1,18gcm−3, a 25°C. É fumegante, tóxico e
corrosivo. Tendo em vista essas informações e considerando-se a densidade da água
1gcm−3, a 25°C, é correto afirmar:
A) A concentração da solução de ácido
clorídrico é, aproximadamente, 10molL−1.
B) O volume de 500mL de solução aquosa de
ácido clorídrico 4,0molL−1 é preparado diluindo-se 125mL de solução
estoque de 38%, em massa, em água até completar o volume para 500mL.
C) A porcentagem em massa de ácido
clorídrico em 1kg de solução obtida, ao se dissolverem 450L de HCl(g)
em 1L de água destilada, nas condições ambiente, é 38%.
D) A quantidade em massa de água usada na
preparação de 1.180g de ácido clorídrico concentrado a 38% é 731,6g.
E) O ácido clorídrico não é um ácido de S.
Arrhenius porque forma, na dissolução aquosa de HCl(g), o ânion
cloreto, Cl−(aq).
Questão 29
Os átomos e as moléculas são entidades tão pequenas, que as unidades
usuais de medida não seriam convenientes para ser utilizados como padrão de
massa atômica e molecular. Como atualmente se sabe que a massa de um átomo de
hidrogênio é 1,66.10−24g, esse valor não seria adequado como
referência. Então surgiu entre os químicos a ideia de usar o átomo do isótopo
12 de carbono de número de massa 12, atribuindo-se como unidade internacional,
de massa atômica, u, 1/12 da massa do átomo desse isótopo. Experimentalmente,
uma unidade de massa atômica, u, é, aproximadamente, 1,66.10−24g.
Levando-se em consideração essas informações e que a massa atômica média
ponderada do átomo do elemento químico cloro é igual a 35,460u, é correto
afirmar:
A) O átomo de cloro tem massa, em gramas, 35,460 vezes maior do que a
massa atômica do hidrogênio.
B) A massa atômica do cloro é 35,460 vezes maior do que a do isótopo 12
de carbono.
C) A relação entre a massa molar do cloro e a massa atômica do carbono é
representada por 35,460u/12.
D) Os átomos de cloro em um conjunto de 6,02.1023 entidades
apresentam massas atômicas iguais a 35,460u.
E) A massa atômica do cloro não corresponde, exatamente, a 35,460 vezes
1/12 da massa do isótopo 12 do carbono.
Questão 30
A aplicação da Lei do Gás Ideal permite deduzir expressões para o
cálculo de grandezas referentes a misturas gasosas, a exemplo da constituída
por 24g de hidrogênio, H2(g), e 64g de metano, CH4(g),
que exerce pressão de 4atm em um recipiente de 100L. Essas informações
possibilitam a cálculo de determinadas grandezas utilizadas no estudo dos
sistemas gasosos ideais e permitem corretamente afirmar:
A) A fração em mol de metano é igual a 4.
B) O volume parcial do hidrogênio na mistura gasosa é igual a 25L.
C) A porcentagem em volume de metano na mistura é igual a 75%.
D) A pressão parcial do hidrogênio é três vezes menor que a de metano na
mistura.
E) A densidade do metano, a 27°C e à pressão de 1atm, é,
aproximadamente, 0,650gL−1.
Questão 31
Curvas de solubilidade são gráficos que apresentam variação dos coeficientes de solubilidade de substâncias químicas em função da temperatura, muito importantes no estudo das soluções de sólidos e de líquidos. O gráfico representa algumas curvas de solubilidade em função da temperatura. Uma análise desse gráfico permite concluir:
A) Os pontos de interseção entre a curva de solubilidade do nitrato de potássio com as outras curvas evidencia que a solubilidade dessas substâncias aumenta com o aumento da temperatura.
B) O processo de solubilidade do sulfato de cério em água é exotérmico, como os demais representados no gráfico.
C) As regiões das soluções de dicromato de potássio supersaturadas correspondem às regiões das soluções
supersaturadas de nitrato de potássio.
D) Ao se resfriar de 80°C a 0°C, uma solução saturada de cloreto de sódio, todo o sal dissolvido se precipita.
E) À temperatura de 5°C, a substância química mais solúvel é o dicromato de potássio.
Questão 32
A mudança do estado sólido para o estado líquido e desse para o estado sólido é denominada processo de fusão ou de congelamento, dependendo do sentido em que acontecem as mudanças. Nesses processos, ocorre consumo ou perda de energia. O gráfico representa esses fenômenos, obtidos a partir de experimentos com água pura. A análise do gráfico, associado a alguns eventos, permite corretamente concluir:
A) O ponto de fusão da água aumenta com o crescimento da pressão.
B) A água gelada no interior de uma garrafa fechada chega a se solidificar quando a garrafa é aberta, porque a pressão no interior diminui até a representada em um ponto situado na região correspondente ao estado sólido.
C) Impurezas solúveis presentes na água, à pressão atmosférica, não causam modificações no ponto de fusão e de congelamento da água.
D) O consumo e a perda de quantidade de energia durante o processo de mudança de estado físico da água de sólido para líquido e deste para sólido possuem valores numéricos relativos iguais.
E) Os patinadores deslizam com facilidade sobre o gelo porque, após exercer pressão sobre este, transforma-o em líquido, estado físico em que permanece.
Questão 33
A formação de uma ligação covalente é um processo em que há liberação de energia. Entretanto, ao se clivar ou “quebrar” uma ligação química, é preciso consumi-la. Quanto maior a energia de uma ligação química, mais forte é a ligação, e mais difícil de “quebrá-la”. Assim, como as entalpias padrão de formação das substâncias químicas podem ser usadas para calcular as variações de entalpia das reações químicas, as energias de ligações químicas também permitem calculá-las com boas aproximações. A partir das informações do texto, dos dados da tabela e da equação química, é correto afirmar:
A) A ruptura da molécula de HI(g) é mais fácil que a da
molécula de I2(g).
B) A variação de entalpia, aproximada, da reação química representada é
443kJ.
C) A entalpia padrão de formação do iodo, de acordo com a equação
química é, aproximadamente, 339kJmol−1.
D) A reação química representada libera 175kJ.
E) Os produtos da reação química precisam absorver 1018kJ para que ela
ocorra.
Questão 34
Muitas reações químicas começam e continuam até o consumo total de, no
mínimo, um dos reagentes. Mas há reações que se estabilizam quando ainda
existem reagentes disponíveis. Nesses casos, a reação atingiu um estado de
equilíbrio químico. Considerando-se essas possibilidades, aquecendo-se 4,0mol
de pentacloreto de fósforo, PCl5 (g), em um recipiente fechado, com
capacidade de 4L, o estado de equilíbrio é atingido quando esse gás é 40%
dissociado em tricloreto de fósforo, PCl3(g), e cloro, Cl2(g),
à determinada temperatura. A partir dessas informações e com base no princípio
de Le Chatelier, é correto afirmar:
A) O valor numérico da constante de equilíbrio na dissociação do
pentacloreto de fósforo é 0,62molL−1.
B) A adição de cloro ao sistema em equilíbrio diminui a concentração de PCl5(g),
e um novo estado de equilíbrio é estabelecido.
C) O resfriamento do recipiente de reação produz aumento das
concentrações de PCl3(g) e de Cl2(g).
D) A concentração de PCl5(g) no equilíbrio químico é 1,2molL−1.
E) A adição de 1,0mol de PCl5(g) ao sistema implica aumento
das concentrações de PCl3(g) e de Cl2(g), que, no novo
estado de equilíbrio químico, são iguais a 0,5molL−1.
Questão 35
A Lei de Diluição de Ostwald relaciona o grau de ionização com o
volume da solução e pode ser enunciada da seguinte forma: O grau de
ionização de um eletrólito aumenta, tendendo a 100%, à medida que a
solução é diluída. A aplicação dessa Lei permite calcular não somente a
constante de ionização, Ka, como também as concentrações e o pH do sistema
em equilíbrio químico representado pala equação química, quando o
grau de ionização do ácido acético, em uma solução 0,02molL−1,
desse ácido, é 3% a 25°C. Considerando-se essas informações e a equação
química de ionização do ácido acético, é correto afirmar:
A) A concentração hidrogeniônica na ionização do ácido acético é
2,0.10−2molL−1.
B) O valor numérico da constante de ionização do ácidoacético é 1,75.10−5molL−1.
C) O pH da solução de ácido acético 3% ionizado é menordo que 4.
D) A concentração de ácido acético no equilíbrio químico é 1,94.10−3molL−1.
E) O valor da constante de ionização, Ka, quando o grau deonização, α,
for muito pequeno, é calculado pela expressão matemática Ka = [CH3COOH]α.
Questão 36
Como todo equilíbrio químico, o equilíbrio heterogêneo obedece à
Lei da Ação das Massas, que, nesse caso, deve ser aplicada à fase aquosa.
O produto de solubilidade ou constante de solubilidade do sulfeto de
ferro(II) pode ser escrito na forma Kps = [Fe2+] [S2−]. Considerando-se
essas informações, é correto afirmar
A) As concentrações de íons S2− (aq) e de
íons Fe2+(aq) iguais a 2.10−10molL−1,
quando, em solução aquosa, promovem a precipitação de sulfeto de
ferro(II).
B) A solubilidade do sulfeto de ferro(II) é,
aproximadamente, 1,97.10−7gL−1.
C) A adição de 1,28.10-6g de cloreto de ferro(II), solúvel
em água, à solução aquosa de sulfeto de ferro(II) em equilíbrio, não
formará mais precipitado desse sal.
D) A retirada de sulfeto de ferro(II) sólido da solução aquosa em
equilíbrio químico produzirá a diminuição das concentrações de Fe2+(aq)
e S2-(aq).
E) A concentração mínima de íons sulfeto, S2−(aq),
para ter início a preciptação de sulfeto de ferro(II) em uma solução
aquosa de 2,0.10−5molL−1 de íons Fe2+(aq), é
2,5.10−15molL−1.
Questão 37
O processo industrial de produção de água sanitária pode ser representado,
resumidamente, pela equação química. O produto é uma solução aquosa de sais,
que possui propriedades bactericidas e alvejantes. Considerando-se esse
processo e as propriedades da água sanitária, é correto afirmar:
A) A ação alvejante do produto se deve à presença de cloreto de sódio em
solução.
B) O hipoclorito de sódio é classificado como neutro porque resulta da
combinação química de uma base forte com um ácido forte.
C) A ação bactericida da água sanitária está relacionada à presença do
ânion hipoclorito, ClO−(aq) em solução.
D) A massa de hidróxido de sódio, suficiente à produção de 75g de
hipoclorito de sódio, é igual ao dobro da massa desse sal.
E) A quantidade de cloro livre na solução aquosa do produto é igual a
zero, porque o hipoclorito de sódio é um sal estável e o cloro reage em
proporções estequiométricas com o hidróxido de sódio.
Questão 38
Uma marca de leite de coco industrializado apresenta as informações
nutricionais, no rótulo da embalagem do produto, resumidas na
tabela. Considerando-se o fragmento da cadeia carbônica
da metilcelulose, a análise das informações do rótulo do
alimento, permite concluir:
A) A porcentagem de gordura saturada em 150g do produto, é de 18%.
B) O índice de iodo das gorduras totais do leite de coco é muito
maior do que o de igual massa de óleo insaturado.
C) A absorção de água, em razão da formação de ligações de
hidrogênio com moléculas de metilcelulose, é indicador de alta
concentração de leite de coco no produto.
D) O leite de coco é uma emulsão no qual o disperso é a água e o
dispersante é a gordura, que forma um agregado de óleo na superfície do
produto na presença de ácido cítrico.
E) O metabissulfito de sódio impede a oxidação do leite de coco na
presença de ar e se transforma em íons
sulfeto, S2−(aq).
Questão 39
Na cidade de Bhopal, situada na Índia Central, com 800 mil habitantes,
na década de 1980, existia uma fábrica de inseticida Sevin, cujo processo
de fabricação está representado, resumidamente, pela equação química. Na
madrugada do dia 3 de dezembro de 1984, houve um vazamento de grande
quantidade de isocianato de metil, sob forma gasosa, extremamente tóxico,
que permaneceu durante dias na atmosfera da cidade. Nesse acidente,
morreram 5 mil pessoas e 50 mil ficaram cegas. O Sevin é usado na lavoura
de soja, milho e algodão transgênicos.
Considerando-se essas informações sobre o Sevin, a equação química e as
propriedades físicas do isocianato de metil, é correto afirmar:
A) O isocianato de metil, à temperatura ambiente de 25°C, e a 1atm, é
uma substância gasosa mais leve que a água.
B) O 1-naftol é uma substância química de propriedades básicas.
C) O grupo funcional do inseticida pertence à classe dos ésteres do
ácido N-metilcarbâmico.
D) A fórmula molecular do 1-naftil-N-metilcarbamato é representada por C10H10ON.
E) A molécula de isocianato de metil tem forma geométrica linear, de
acordo com a teoria da repulsão dos pares eletrônicos da camada de
valência, e possui pressão de vapor a 39,5°C superior à da água a 100°C.
Questão 40
Após a extração, o petróleo é transportado até as regiões consumidoras, por meio de oleodutos ou de superpetroleiros, navios gigantescos que deslocam até 750mil toneladas de óleo. Nas refinarias, o petróleo cru é tratado e refinado, inicialmente, por meio de processos de destilação fracionada, à pressão atmosférica e à pressão reduzida, como ilustrado na figura. A análise das torres de destilação e das frações coletadas durante esse processo de refino e com base nos conhecimentos de Química, é correto concluir:
A) Durante a destilação fracionada, nos pratos da coluna de destilação, o líquido condensado tem maior concentração de hidrocarbonetos de menor pressão de vapor, quando comparado ao líquido no prato superior.
B) Os produtos de massa molar maior são coletados no topo da coluna de destilação fracionada.
C) Os principais hidrocarbonetos existentes na gasolina e no óleo diesel são encontrados em grande concentração nos óleos combustíveis.
D) Óleos lubrificantes destilam a temperaturas mais altas do que a do resíduo pesado, quando no interior da coluna de destilação, à pressão reduzida.
E) À pressão reduzida, as temperaturas de ebulição dos óleos lubrificantes são maiores do que à pressão atmosférica.








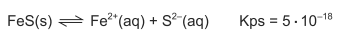







Comentários